Сельское хозяйство
Разработка биотехнологического приема и отбора по признаку высокой, генетически детерминированной устойчивости организма к стрессу
Лента новостей
Куда вложиться в недвижимость этим летом — обзор рынка от Дубовика
Нотариусы рассказали, как участникам СВО защитить свое имущество
83% офисных работников смотрят только на себя в рабочих звонках
Московское гостеприимство: что привлекает туристов в российской столице
Названы 100 лучших проектов участников шестого потока «Академии инноваторов»
Введение
Особо важное место в профилактике стрессов занимают создание типов животных с высоким адаптивным потенциалом и селекция их по стрессустойчивости. Повышение жизнеспособности человека и животных – главная цель науки [6, 21, 24, 25, 26, 27]. На жизнеспособность человека оказывают влияние и генетические процессы в популяции, прежде всего, повышенная скорость обновления генома (повышенная гетерозиготность). Она обусловлена смешением популяционных генофондов, происходящим в результате многонационального состава населения и обширности территории страны, способствующей возникновению региональных отличий генотипа даже внутри одной и той же этнической группы. Повышенная гетерозиготность генома обостряет иммунологический конфликт между организмом беременной женщины и плодом и при недостаточном питании приводит к развитию у беременной железодефицитной анемий, отставанию в развитии плода, повышению репродуктивных потерь, и ухудшению здоровья детей [23, 28, 31]. Созданные цивилизацией и научно-техническим прогрессом гиподинамия (снижение силовых нагрузок) и гипокинезия (ограничение двигательной активности) не только отрицательно влияют на системы кровообращения, дыхания, обмен веществ, опорно-двигательный аппарат, нервные и гуморальные регуляторные механизмы, но и непременно ведут к снижению реактивности организма и развитию стресса, ростом, так называемых болезней стресса [28].
Селекция и отбор по признаку высокой, генетически детерминированной устойчивости организма к стрессу — наиболее важные пути совершенствования сельскохозяйственных животных, пригодных к требованиям интенсивной технологии в экологическом отношении неблагополучных регионах страны.
В настоящее время известны способы определения стрессустойчивости и стрессчувствительности и они еще не достаточно отработаны, трудоемки и требуют определенных условий. Необходимы дальнейшие поиски более простых, надежных и объективных способов оценки чувствительности животных к воздействию стресс-факторов, широкие исследования по использованию этих методов в селекционной работе, направленной на выведение стрессустойчивых пород, линий, гибридов, отличающихся высокой жизнеспособностью и продуктивностью и дающих в экологическом отношении качественную продукцию [1, 2, 3, 4, 5].
Известен способ поддержания физиологического статуса новорожденных телят, который связан с применением неспецифических средств, впервые дни жизни для коррекции физиологических процессов в пищеварительной системе [9].
В отечественной науке известен способ коррекции иммунологического статуса новорожденных животных в ранние периоды постнатального онтогенеза [15].
Мы считаем, что нужна такая технология поддержания физиологии беременности до рождения, которая предупреждает развитие различных патологии и стресса новорожденных животных. Однако, при этом для совершенства терморегуляторных и иммунобиологических процессов будущего потомства млекопитающих должен быть комплексный подход, по нашему мнению надо использовать и природные естественные технологические приемы в период беременности, начиная со второй половины, когда начинается интенсивный рост и развитие плода. Результаты воздействия природных факторов окружающей воздушной среды на беременных животных в первую очередь отражаются в клетках периферической систем крови. Поэтому для изучения и определения состояния защитных иммунных клеток, надо использовать периферическую систему крови, которая находится в зависимости от периферических рецепторных аппаратов нервной системы. Выбор системы крови новорожденных животных в качестве объекта исследования был не случаен, поскольку кровь чутко реагирует на различные воздействия экологических факторов окружающей среды. Новорожденные животные впервые часы жизни, подвергается воздействию различных факторов внешней среды [9, 10, 11]. Интерес к системе крови определяется еще тем, что именно данная система представляет собой внутреннюю среду, которая играет решающую роль в неспецифических и специфических реакциях защиты новорожденного и взрослого организма, влияя на его естественную резистентность и иммунобиологическую реактивность. При этом естественные факторы окружающей среды, способствуют к формированию терморегуляторных и иммунобиологических механизмов, начиная со второй половины беременности, включая и желез внутренней секреции, т.е. гормональную систему [1-14, 20, 21, 22]. Стресс вызывает атрофию дендритов гиппокампа CA3 пирамидальных нейронов. Гиппокамп уязвим для разрушительных действий оскорбления в виде различных раздражителей (стрессов) , такие как преходящей ишемии и ритмической стимуляции, а также повторное воздействие экзогенных глюкокортикоидов. Это исследование последствий повторного психологического стресса, сдержанность, на CA3 пирамидальные нейроны, которые уязвимы для повреждений ритмической стимуляции. Повторные ежедневного стресса сдержанность в течение 21 дней вызвал апикальных дендритов пирамидальных нейронов CA3 к атрофии, а базальные дендриты CA3 не изменилась. Крысы, которые прошли лечение и от этого были здоровы и показали некоторые адаптации глюкокортикоидной реакции на стресс в течение 21 дней, однако стресс уменьшить веса тела на 14% и увеличение веса надпочечников относительно веса тела на 20%. Результаты обсуждаются в связи с возможной роли надпочечников стероидов и возбуждающих аминокислот [20, 29, 32].
Материал и методы исследований
С учетом поставленной цели и задач исследований и особенностей изучаемого явления использовали комплекс иммунологических, физиологических, биохимических и гематологических методов исследований.
Стрессреактивность животных устанавливалась путем постановки:
адреналиновой пробы с предварительным смешиванием периферической крови с 0,1% раствором адреналина гидрохлорида и с 1%ным водным раствором метилрозацилина или металвиолета, а ее исследование проводилось через 30, 60 и 120 минут путем подсчета неразрушенных форм лейкоцитов в камере Горяева и норадреналиновой пробы, для этого в две пробирки вносили по 0,1 мл. периферической крови животного.
В первую пробирку (опытную) добавляли 0,9 мл. 0,2% раствора норадреналина гидротартрата, а во вторую (контрольную) 0,9 мл. стерильного физиологического раствора. Пробы тщательно перемешивали и помещали в термостат на 2 часа при температуре 37,5˚ С. После инкубирования через 2 часа для подсчета неразрушенных форм мононуклеаров брали взвеси из опытной и контрольной проб и готовили мазки. Мазки окрашивали по методу Паппенгейма. Для чего сухие нефиксированные мазки помещали в контейнер и опускали в кювету с раствором красителя-фиксатора Май — Грюнвальда на 5 минут, после чего контейнер с мазками ополаскивали в кювете с дистиллированной водой и помещали в кювету с рабочим раствором азур-эозина (по Нохту) на 8-15 минут. Затем сливали краску, перенося кювету с водопроводной водой. Мазки высушивали на воздухе. Подсчет неразрушенных мононуклеаров (лейкоцитов) проводили в тонкой части мазка, где эритроциты лежат одиночно. Для нахождения процента разрушенных мононуклеаров крови животного под действием 0,2% раствора норадреналина гидротартрата использовали формулу:
ПСРМ = 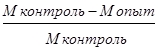 · 100;
· 100;
Где ПСРМ – показатель стрессрезистентности мононуклеаров; М – мононуклеары.
Состояние естественной резистентности оценивалось по показателям опсонофагоцитарной реакции (В.С. Гостев, 1951); лизоцимной активности сыворотки крови (В.Г. Дорофейчук, 1963); титру гетерогемагглютининов.
Для определения стресс-реакции брали кровь и выявляли состояние стресса в аппарате Панченкова. Затем в пипетку набирали 0,1% раствор адреналина гидрохлорида, доведенный до изотонической концентрации хлористым натрием, до метки Р и выливали на часовое стекло. После этого пипетку прополаскивали раствором гепарина до метки Р и той же пипеткой набирали кровь у животного до метки К и выливали на часовое стекло в раствор адреналина гидрохлорида. Кровь и раствор адреналина гидрохлорида перемешивали концом пипетки и наполняли эту же пипетку адреналиногидрохлоридной кровью до метки О и ставили в штатив. Аналогичным образом ставили контрольные пробы с изотоническим раствором хлористого натрия содержащий 0,01 н. раствор соляной кислоты. Исходя из того, что раствор адреналина гидрохлорида содержит 0,01 н. раствор соляной кислоты, в контрольную пробу добавляли 0,01 н. раствор соляной кислоты. РН 0,1% раствора адреналина гидрохлорида и изотонического раствора хлористого натрия после добавления 0,01 н. раствора соляной кислоты имели одинаковые величины.
Результаты стресс-реакции организма животных в опытных и контрольных пробах определяли по скорости оседания эритроцитов через 15 минут. Учет осуществляли визуально. Состояние стресса констатировали в том случае, когда разница скорости оседания эритроцитов в опытной и контрольной пробах составляла 0,3 мм и выше. Стресс-реакции с определением скорости оседания эритроцитов периферической крови в 0,1% растворе адреналина гидрохлорида в аппарате Т.Н. Панченкова за 15 минут.
Биохимические методы применяли при определении белковой картины крови. Общий белок определяли рефрактометрически; а белковые фракции – электрофорезом в теле агара (П.Грабар, П. Буртен, 1963). Количество общего кальция в сыворотке комплексонометрически. Неорганический фосфор в сыворотке крови – по Бриггсу в модификации С.И. Ивановского /1972/. Резервную щелочность в плазме крови – по Ван-Сляйку (1969).
Гематологические методы применялись для определения количества эритроцитов, лейкоцитов, гемоглобина, скорости оседания эритроцитов, бляшкообразующих клеток и розеткообразующих лейкоцитов крови. Содержание эритроцитов и концентрацию гемоглобина определяли фотоэлектроколометрическим методом (Г.В. Дервиз, А.И. Воробьева, 1959). Лейкоциты подсчитывали в счетной камере, скорость оседания эритроцитов – в аппарате Т.Н. Панченкова. Количество аутоиммунных бляшкообразующих клеток определяли по методике Н.Н. Клемнарской (1978). Аутоиммунные розеткообразующие клетки в мазках крови животных, окрашенных по Романовскому-Гимза, обнаруживали путем подсчета 100 клеток в двух продольных полосках мазка. Дифференциальный подсчет лейкоцитов проводился в мазках, окрашенных по методу Романовского-Гимза.
В качестве показателей уровня морфо-функционального развития новорожденных животных использовали живую массу, размеры, тип телосложения, проявления врожденных рефлексов, клинические показатели (частота пульса и дыхания). Об интенсивности роста и развития молодняка жвачных животных судили по абсолютному приросту и среднесуточному приросту.
В качестве объекта исследования и определения стрессчувствительности новорожденных животных использовали периферическую кровь из пуповины и яремной вены.
Для определения стрессчувствительности в две пробирки вносили по 0,1 мл крови новорожденного животного. В первую пробирку (опытную) добавляли 0,9 мл 0,1% раствора адреналина гидрохлорида, а во вторую (контрольную) — 0,9 мл. стерильного физиологического раствора. Пробы тщательно перемешивали и ставили в термостат на 30, 60, 120 минут при температуре 37,5˚ С. После инкубирования через 30, 60, 120 минут перед каждым очередным подсчетом брали 0,1 мл. взвеси с опытной и контрольной проб и смешивали с 0,1 мл. 1% раствором водного метилрозацилина или метилвиолета той же концентрации и объема. Затем содержимым обеих проб заполняли камеру Горяева и подсчитывали количество лейкоцитов в 25 больших квадратах по обычной методике, принятой для подсчетов. Для нахождения процента разрушенных лейкоцитов новорожденного животного под воздействием 0,1% раствора адреналина гидрохлорида использовали формулу:
ПЧСЛ = 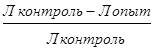 · 100%
· 100%
где ПЧСЛ – показатель стрессчувствительности лейкоцитов, Л – лейкоциты.
Результаты исследований
Экспериментальные и производственные исследования проводились на овцах породы прекос. Для исследования созданы две группы животных (опытная и контрольная), в каждой 400 овцематок. Первая группа овцематок со второй половины суягности (опытная) содержалась в зимне-весенний период на открытой площадке круглосуточно на глубокой соломенной подстилке, а вторая группа (контрольная) в помещении и на выгульной площадке – кошарно-базовым способом. По мере получения ягнят аналогично создавали две группы животных. От опытных овцематок было получено 342 ягненка, а от контрольных 318.
Рацион для овцематок и их ягнят составлялся по нормам ВИЖа, одинаково по каждой группе.
Новорожденных ягнят из каждой группы из 10 животных, оценивали по показателям физиологической зрелости с учетом температуры тела первые 8 часов и по живой массе тела.
В дальнейшем, через 30, 60, 90 дней после рождения, изучали у ягнят физиологические и биохимические показатели крови, кроме того, учитывали рост и развитие. Кровь для физиологического и биохимического исследования у ягнят брали из яремной вены в утренние часы до кормления.
Для изучения у овец взаимоотношения между поведенческими реакциями и особенностями специфического и неспецифического реагирования на длительное действие холода, овцематок за 10 дней до окота в зимне-весенний период содержали, при отрицательной температуре на выгульной площадке. До и после 9-недельной холодовой экспозиции определяли стрессчувствительность животных и параметры поведенческих реакций. Интервал между этими исследованиями составлял 6-7 дней. Для оценки гематологической функции у овцематок в утренние часы до кормления брали кровь из яремной вены за 10 дней до холодового воздействия и через 15, 30, 60 дней после перевода животных на выгульную площадку [30].
Предназначенные для исследования животные были клинически здоровыми, одного возраста, пола и массы. Они находились в одинаковом физиологическом состоянии. Животные были средней упитанности. Перед началом исследований животные подвергались клиническому осмотру и термометрии тела в течение 3 дней. До начала исследования все подопытные животные предварительно были пронумерованы. В период проведения исследований соблюдались зоогигиенические, зоотехнические и ветеринарные требования за уходом, содержанием и кормлением животных.
Изменения живой массы у животных учитывали по данным ежемесячных взвешиваний. Одновременно определяли микроклимат помещений, где находились животные. Кроме того, учитывали заболеваемость и падеж животных.
Статистическую обработку проводили методом вариационной статистики по Н.А. Плохинскому (1961). Весь цифровой материал обработали статистическими методами на калькуляторе «Электроника МК-56». Достоверность различия определяли по таблице Стьюдента
Одним из факторов повышения устойчивости животных является использование резервов самого организма. Для этого необходима оптимизация физиологических функций. Принципы и способы оптимизации физиологических функций организма жвачных животных к условиям различных регионов России и Ближнего Зарубежья в зимне-весенний период года не разработаны.
Исходя из вышеизложенного, нами был разработан способ повышения неспецифической естественной резистентности у овец в системе мать-плод-новорожденный.
Сущность способа повышения неспецифической резистентности у овец в системе мать-плод-новорожденный заключается в том, что овцематки со второй половины суягности за 10 дней до родов круглосуточно содержали в умеренных минусовых температурных условиях. Для чего и использовали катон (устройство) нашей модификации. Катон включает щитки-решетки с кормушками – 1,5; вентиляционное отверстие –2, ворота –3, основание –4. Катон отличается от известных технических решений тем, что с целью повышения эффективности и упрощения способа, устройство (катон) выполнено разборным и с кормушками укреплениями неподвижно на щитах (рис.). Изучение возрастных особенностей жизнеспособности ягнят является важным вопросом катонно-стойлового содержания их в условиях Казахстана. Для изучения этого вопроса нами поставлен опыт на грубошерстных, мясосальных овцематках, выращенных в катонах нашей модификации и кошаре, со второй половины суягности за 10 дней до родов, с целью выявления влияния разных условий содержания на резистентность потомства.
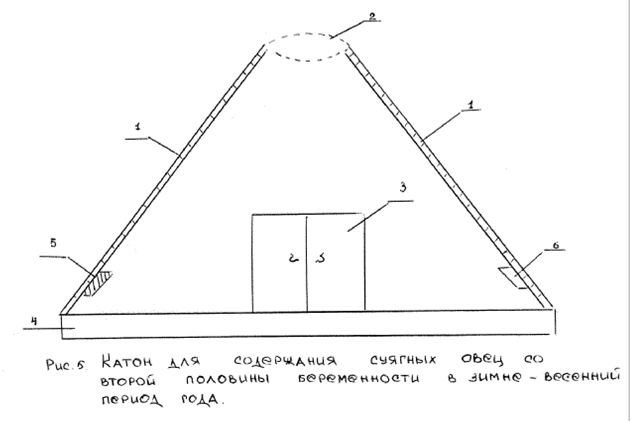
Первая группа (контрольная) в зиму находилась в кошаре-отаре овцематок (582 головы), где на одно животное приходилось 0,25 м2 площади. Вторую (опытную) группу содержали в другой отаре овцематок (622 головы) в полузакрытом катоне. Катон сооружался на выгульной площадке, которая состоит из щитов-решеток высотой 4 м. Снаружи решетки обкладывали толстым слоем соломы. Сверху оставляли вентиляционное отверстие диаметром до 2 м. Сбоку устаивали ворота размером: высота 2,5 м., ширина 3 м. Основание катона прилегает на глубокую соломенную подстилку и имеет 16 метровую ширину.
Рацион кормления для овцематок двух отар был одинаковым. На протяжении опыта животные получали дополнительное сено, солому, концентраты, поваренную соль.
Различные условия содержания овцематок и длительное воздействие низкой температуры отразилось на физиологическом состоянии и морфологическом составе крови, полученных от них ягнят.
Температура тела у всех подопытных ягнят находилась в пределах физиологической нормы и имела достоверные различия (Р<0.05).
Количество ударов пульса у всех овцематок снижалось, но в 120 дневном возрасте отмечено некоторое его увеличение, как следствие повышения температуры атмосферного воздуха. Однако частота пульса у животных по группам была не одинакова. Так, у животных, полученных от овцематок, которые содержались кошарно-базовым способом при рождении показатели первой группы были ниже, чем у ягнят второй группы, полученных от овцематок, которые содержались в катоне нашей модификации.
После перевода ягнят в сакманное отделение, где температура воздуха была ниже, чем в цехе ягнения, частота дыхания заметно изменилась: отмечено самое редкое дыхание, которое у ягнят первой и второй групп соответственно на 34.5 и 42.1% (Р<0.001) по сравнению с данными ягнят в недельном возрасте.
Следовательно, частота дыхания у ягнят обоих групп коррелировала с показателями температуры помещения и внешней среды.
Количество эритроцитов в крови ягнят в обеих группах к 30 дневному возрасту повысилось на 57.6 ( Р<0.001), в 60 дневном возрасте снизилось на 30,7% /(Р<0.001) с последующим постепенным увеличением их к 90-дневному возрасту на 9,5% (Р<0.001).
Результаты исследования показывают, что количество эритроцитов в крови ягнят в ранние периоды постнатального онтогенеза непостоянно и имеет тенденцию к периодическому спаду и нарастанию.
Содержание лейкоцитов в крови ягнят с возрастом значительно изменилось. У животных обеих групп наибольшее количество их отмечалось в 30 дневном возрасте, которое постепенно снижалось к 90 дневному возрасту.
Лизоцимная активность сыворотки крови во все возрастные периоды коррелировала с ростом ягнят.
Фагоцитарная активность нейтрофилов у подопытных ягнят в 60 дневном возрасте составляла в пределах 57-65%, увеличение фагоцитоза отмечено в последующие возрастные периоды.
Заключение
Таким образом, у ягнят, полученных от овцематок, содержащихся в катонах нашей модификации, стрессрезистентность организма была выше, чем у молодняка, полученного от животных, которые содержались кошарно-базовым способом.